品質への取り組み
Qualityトラストファーマテックは、グループ会社である沢井製薬の製造受託企業として、沢井製薬の製品を製造しています。
2022年4月より準備を進め、2023年春に製品の出荷を開始。
「なによりも患者さんのために」という企業理念のもと、ジェネリック医薬品の安定供給と品質向上に取り組む、
トラストファーマテックの生産および品質管理体制についてご紹介します。
品質方針
サワイグループは、品質に関する効果的で適切な業務の遂行を保証するために、以下の品質方針「Sawai Group Quality Policy」を掲げています。経営陣および社員は、ステークホルダーの皆さまと密接でタイムリーなコミュニケーションを図り、グループで定めた品質管理体制にもとづく活動により、患者さんの生活の向上に貢献してまいります。
Sawai Group Quality Policy
- 患者さんのニーズを理解し、そのニーズに応えた高品質な製品及びそれらの情報を提供します。
- 製品を開発及び販売している地域の品質に関する規制を遵守し、規制当局に完全かつ正確な情報を提供します。
- 継続的な教育訓練、経営陣及び従業員の積極的な関与を通じて、強いQuality Cultureを醸成します。
- 顧客への製品の安定供給に努めます。
- 知識管理に基づく最新の科学的アプローチに従ったプロアクティブな取り組み及び継続的改善を実施します。
トラストファーマテックでは、サワイグループの品質方針にもとづき、特に製品の安定供給と品質管理体制を強化しています。安定供給することも製品の品質であると考え、品質に関する規制の遵守とともに、社員への継続的な教育訓練を徹底しています。
生産体制
トラストファーマテックは、福井県あわら市に3つの製造工場を設け、生産能力年間約30億錠分の設備を保有しています。
製造施設の一覧はこちら
今後、人員体制などを補強していき、実生産能力を年間30億錠にすることを目指します。これにより、沢井製薬の年間200億錠以上の生産体制への貢献が期待されています。
安心してお使いいただける真心をこめたジェネリック医薬品を、安定的に供給し続けることを使命として取り組んでまいります。

福井県あわら市矢地エリア

福井県あわら市清間エリア
設備の特徴
最新鋭の製造機器を備える工場では、効率的な生産システムを構築しています。
これは、グラビティシステムと呼ばれるもので、工程順に上下の動線で原材料や中間製品が可能な限りヒトの手に直接触れることのないように動く流れをつくることで、ヒト・モノの移動にかかるスペースや時間などの効率性を高め、生産効率の向上に寄与する仕組みとなっています。
例えば、各製造工程でできた中間製品が入ったフロービンは、中央にあるクリーン自動倉庫に移動します。その後、次の工程でそのフロービンを呼び出し、クリーン自動倉庫から次工程の作業室に移動します。この時、クリーン自動倉庫が上下の各作業室に隣接する中央に位置するため、フロービンを呼び出す時間や次工程に移動する時間を短縮することができます。
これにより生産効率が向上し、生産数量の増加に貢献しています。
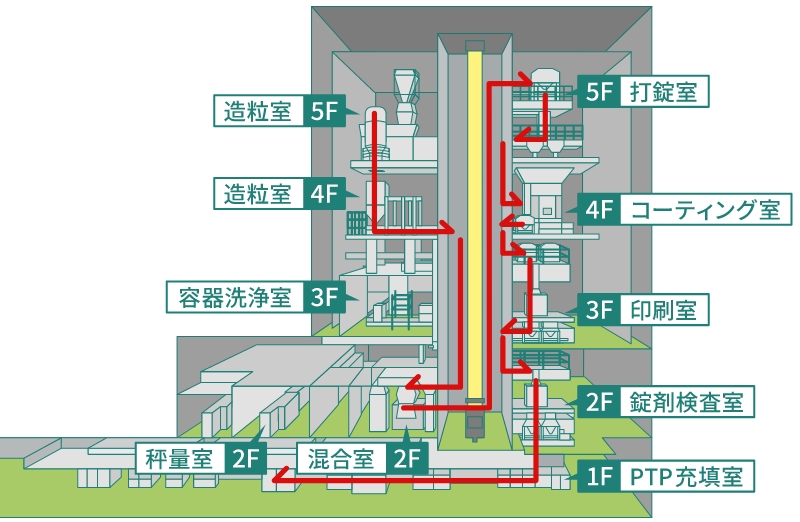
グラビティシステムのイメージ
品質に対する基本姿勢
トラストファーマテックでは、グループ会社である沢井製薬と同じ「なによりも患者さんのために」という企業理念にもとづき、より良い品質のジェネリック医薬品の提供に努めます。
そのためには、社員一人ひとりが、医薬品づくりという仕事に対して誇りを持ち、また、社員一人ひとりが生き生きと精力的に働ける職場環境をつくることが大切であると考えています。
1錠の錠剤を思い浮かべてください。
私たちはこの錠剤を科学的に分析してその品質を管理しています。
- 錠剤に有効成分は入っているでしょうか?
- その量は規定どおりでしょうか?
- 不純物は入っていないでしょうか?
- 錠剤中の有効成分は溶けなければ体内で吸収されません。有効成分は錠剤から溶け出るでしょうか?
私たちが考える品質はこれだけではありません。錠剤の安定性確認、試験データの信頼性向上など、患者さんおよび私たちの製品を取り扱ってくださる皆さまのご要望すべてが品質であると捉えています。そして、私たち一人ひとりが品質を育てています。
私たちは、まだ芽吹いたばかりですが、近い将来、花を咲かせ、実をつけ、より良い品質のジェネリック医薬品を提供することで皆さまのお役に立ちたいと考えています。これも私たちが考える品質です。

GMP遵守のための体制
医薬品の製造や品質の管理にはGMP(Good Manufacturing Practice)と呼ばれる厳しい基準が法令によって定められています。これは、原材料の入荷から製品の出荷までを定められた手順に従って製造し、高品質で安全な医薬品をつくるためのルールであり、3つの基本原則が掲げられています。
この基本原則に沿って、トラストファーマテックで行っている取り組みをご紹介します。
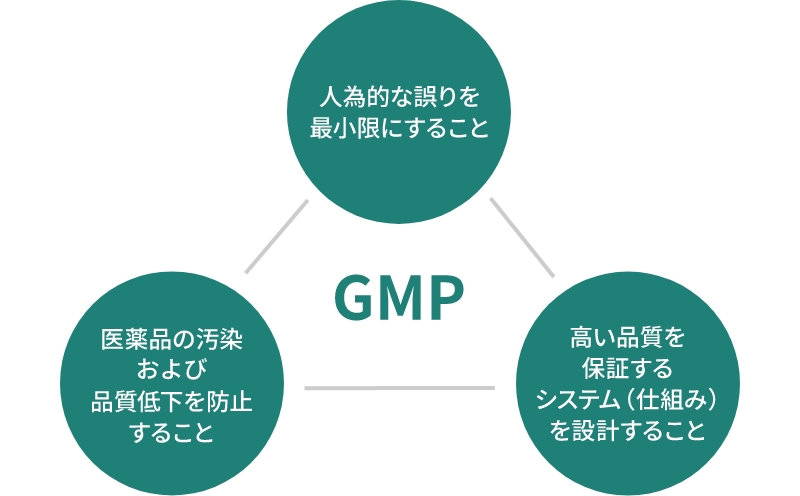
①人為的な誤りを最小限にすること(間違い防止)
MES(Manufacturing Execution System)と呼ばれる製造実行システム※やLIMS(Laboratory Information Management System)と呼ばれる品質試験情報管理システムを導入することで、人為的なミスを最小限に抑え、各工程で定められた試験での検査に合格しなければ次の工程に進めないような仕組みを構築しています。
例えば、MESでは各製造工程の作業者へ指示を出し、登録された原材料がGMPに沿った正しい製造工程、手順で取り扱われていることを管理しています。また、LIMSでは品質試験結果の記入ミスや改ざんなどを防ぎ、品質試験が手順に従って適切に行われたことを管理し、試験結果に関する情報を正しく維持・管理しています。
※一部の工場では、自社独自のシステムで運用

システムによる管理に加え、作業におけるミスを最小限にするために、重要な工程ではダブルチェックも行っています。
また、社員一人ひとりに継続してGMP教育訓練を行っています。習熟度が一定レベルに達した者や作業資格認定を受けた者のみが作業に従事できる仕組みを整えること、そして、各人の教育記録を残すことで品質意識を高め、医薬品を製造するうえでのGMP遵守の徹底に取り組んでいます。さらに、座学による教育訓練だけではなく、手順書に定められたとおりに行われているかを製造現場で確認し、巡視による指導も行っています。
このような教育の積み重ねによる啓発とともに、製造現場から改善策を考えられる仕組みづくり等、人財力の強化に努めています。
②医薬品の汚染および品質低下を防止すること(汚染防止)
工場ではクリーンな環境をつくることを徹底しています。作業員が自ら異物を持ち込まないことを徹底し、健康管理、ゾーンごとの専用の無塵衣とゴーグルの着用や手洗い・消毒、また、入退室のルールの遵守なども徹底しています。
工場の設備も、作業室と通路やクリーン自動倉庫との間の気圧の差をつくることで、空気が作業室から他のエリアに拡散しない仕組みをつくり、各作業室に粉塵を封じ込め、廊下に粉塵を出さないようにしています。また、ヒトと原材料、ヒトと製剤との接触をできるだけ減らし、各工程は1ルーム1マシンを基本※とする考え方でつくられています。
※一部の工場では、造粒室に撹拌造粒機と流動層造粒乾燥機が各1台設置されている場合もあります。
このように、有効成分の混在を避ける仕組みに加え、機器や作業室の清掃を徹底することで、異なる複数の医薬品をつくる工場であっても、常にクリーンな環境を維持しています。

衣類に付着した埃、皮脂など、ヒトが一番の汚染源とされていることから、作業員は自ら異物を持ち込まないように徹底しています。
③高い品質を保証するシステム(仕組み)を設計すること(品質保証システム)
品質保証を客観的に行うため、品質保証部門は製造部門や品質管理部門から独立しています。決められた製造方法および試験検査方法であればいつも一定の結果になることをあらかじめ確認し、文書化する作業(バリデーション)を行い、品質の均質化を図っています。
また、品質に関する情報をサワイグループ内で共有し、問題に対して迅速に取り組める体制を整えています。品質試験結果において「通常とは異なる警告を検知」した場合、原因を究明するとともに、不正が行われないように、定められたルールに従って適切な対応を行います。

出荷後の製品についても、患者さんにいつでも安心して服用いただけるよう、安定性モニタリングを行い、品質を厳しくチェックしています。
製造工程における品質確認
出荷される最終製品の試験・検査だけでなく、原材料の受け入れから製造・出荷までの各工程で、厳しい試験や検査で品質管理を行っています。各工程で確認した内容は記録に残し、問題がないことを確認してから次の工程へ引き渡します。
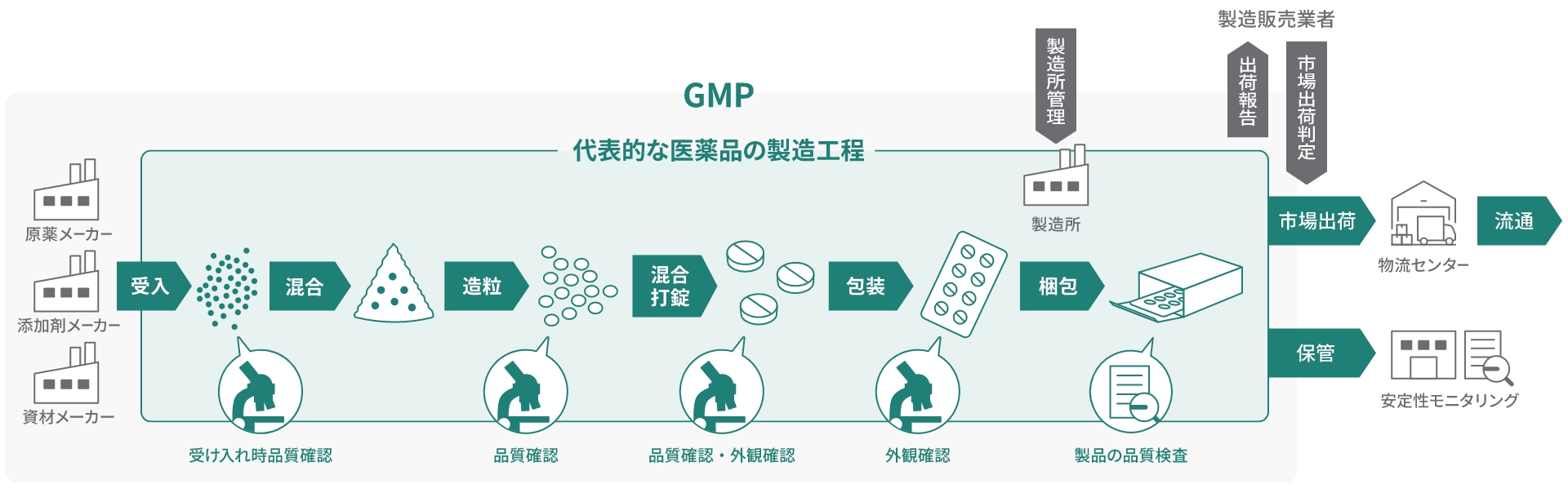
原材料の受け入れ
原材料を入荷した際に、その品質を確認します。原材料が適正なものか、その純度に問題がないかなど、国が定める基準よりも厳しいサワイグループの基準に合格した原材料のみを使用します。


原材料の登録
基準に合格した原材料をMES(製造実行システム)に登録し、製品が完成するまでの各工程を管理します。このように管理することで、指示された手順以外の操作をした際にはエラーとなるため、間違った原材料の持ち込みや使用を防止できます。


原材料の受け入れ時に、バーコードラベルを貼ります。
作業担当者はバーコードを読み込んだ際、その原材料が合格したか、まだ試験中であるかがわかります。
【ダブルチェック体制の構築】
製造部門での受け入れ後、原材料の入出荷担当部門でも残量の管理・確認を行い、間違いを防ぐ対策を行っています。
造粒・整粒・混合
原材料を量り、均一に混ぜ合わせたのち、粉末状の原材料を粒状にして、後の工程で錠剤の形にしやすくするための操作を施します。この工程は、医薬品の溶け方や効き方が均一になるために重要な工程です。



打錠
均一に混ぜ合わせた粒の状態から、打錠機で押し固め、錠剤の形にしていきます。
途中、サンプルを抜き取り、錠剤の厚み、硬度、質量をチェックし、正しく打錠されているか確認します。その後、製造する製品がフィルムコーティング錠の場合、コーティング機で錠剤表面にフィルムを形成します。



各工程で確認した内容はすべて記録に残しています。確認した内容に問題ないことを確認したうえで、次の工程へ引き渡します。
印字・検査
錠剤に錠剤印刷機やレーザー印刷機を用いて印字したのち、錠剤は錠剤検査機を通り、カメラで1錠ずつ、変形、割れ欠け、汚れ、印字不良がないかなど、すべての錠剤の形状と外観を検査します。



包装・外観確認
全数検査された錠剤をPTPシート※やポリエチレン瓶に包装します。この工程においてもPTPシートの外観や錠剤の割れ欠け、汚れなどをカメラ検査機で確認します。さらに、錠剤の数・重さ、製品番号・使用期限の印字も確認しながら、製品ごとにデザインされた個装箱に正しく包装、封緘されていきます。製品になる最後まで、わずかなミスも起こさないよう努めています。
※PTP(Press Through Package)シート:プラスチックとアルミで錠剤を挟んだシート状の包装形態。このシートから押し出すようにして錠剤を取り出す。
品質試験
包装・検査された製品から一部を抜き取り、製剤の性状(色や形など)が適正か、有効成分が設計したとおりに含まれているか、その有効成分量の錠剤ごとのバラツキは基準範囲内か、一定時間内に溶け出した有効成分が正しい量か、不純物が入っていないかなどの品質試験を実施します。サワイグループの基準を満たしたものになっているかを最終確認します。



この試験内容も試験情報を管理するシステム(LIMS)で管理され、人為的なミスを最小限に抑えます。
そして、試験に合格した製品のみが出荷されます。
梱包・書類の確認
製品の出荷前にも、製品の品質と製造工程が適正な作業環境下で手順どおりに行われたか等、プロセスが適正であったかの最終確認を文書にもとづいて行い、品質保証部門が合格判定を行って出荷の準備をします。
出荷
数多くの試験に合格した医薬品のみが製品となり、患者さんの元へ届けられます。

保管・安定性モニタリング
出荷後の製品についても、患者さんにいつでも安心して服用いただけるよう、安定性モニタリングを行い、品質を厳しくチェックしています。
このように、機械とヒトによる管理・検査を繰り返すことでミスを防ぎ、サワイグループの品質基準に沿った高い品質の医薬品づくりを行っています。
